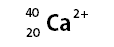1. Dels següents elements indica raonadament quins
tindran propietats químiques semblants i quins elements tindrà el mateix nombre
de capes electròniques: Li, Mg, Na, P, Ca, F, Cl, O, N, K. Dades: Z(Li)=3, Z(Mg)=12,
Z(Na)=11, Z(P)=15, Z(Ca)=20, Z(F)=9, Z(Cl)=17, Z(O)=8, Z(N)=7, Z(K)=19.
Z(Li)=3
Tindrà 3
protons i 3 electrons. En la primera capa hi haurà 2 electrons i en la segona 1
electró. És a dir, té 1 electró en l’última capa.
Z(Mg)=12
Tindrà 12
protons i 12 electrons. En la primera capa hi haurà 2 electrons, en la segona 8
i en la tercera 2 electrons. És a dir, té 2 electrons en l’última capa.
Z(Na)=11
Tindrà 11
protons i 11 electrons. En la primera capa hi haurà 2 electrons, en la segona 8
i en la tercera 1 electró. És a dir, té 1 electró en l’última capa.
Z(P)=15
Tindrà 15
protons i 15 electrons. En la primera capa hi haurà 2 electrons, en la segona 8
i en la tercera 5 electrons. És a dir, té 5 electrons en l’última capa.
Z(Ca)=20
Tindrà 20
protons i 20 electrons. En la primera capa hi haurà 2 electrons, en la segona
8, en la tercera 8 i en la quarta 2 electrons. És a dir, té 2 electrons en
l’última capa.
Z(F)=9
Tindrà 9
protons i 9 electrons. En la primera capa hi haurà 2 electrons i en la segona 7
electrons. És a dir, té 7 electrons en l’última capa.
Z(Cl)=17
Tindrà 17
protons i 17 electrons. En la primera capa hi haurà 2 electrons, en la segona
8, en la tercera 7 electrons. És a dir, té 7 electrons en l’última capa.
Z(O)=8
Tindrà 8
protons i 8 electrons. En la primera capa hi haurà 2 electrons i en la segona 6
electrons. És a dir, té 6 electrons en l’última capa.
Z(N)=7
Tindrà 7
protons i 7 electrons. En la primera capa hi haurà 2 electrons i en la segona 5
electrons. És a dir, té 5 electrons en l’última capa.
Z(K)=19
Tindrà 19
protons i 19 electrons. En la primera capa hi haurà 2 electrons, en la segona
8, en la tercera 8 i en la quarta 1 electró. És a dir, té 1 electró en l’última
capa.
Després de
separar els electrons per capes, ja podem agrupar els elements que tenen
propietats químiques semblants, i són:
- Li, Na i K,
perquè els tres tenen 1 electró en l’última capa.
- Mg i Ca,
perquè els dos tenen 2 electrons en l’última capa.
- P i N,
perquè els dos tenen 5 electrons en l’última capa.
- O, les propietats
d’aquest element no seran semblants a cap dels de la llista perquè és l’únic
que té 6 electrons en l’última capa.
- F i Cl,
perquè els dos tenen 7 electrons en l’última capa.
També observem
els elements que tenen el mateix nombre de capes electròniques, que són:
Li, F, O i N,
que tenen 2 capes.
Mg, Na, P i
Cl, que tenen 3 capes.
Ca i K, que
tenen 4 capes.
2. Si saps que el liti té un 1 electró en l'última
capa, el beril·li 2, el bor 3, el carboni 4, el nitrogen 5, l'oxigen 6, el fluor 7 i el neó 8, indica
raonadament quin dels elements de dalt tindrà propietats químiques semblants al
Si si saps que Z(Si)=14.
Per a saber
quin element químic té propietats químiques semblants al Si, el primer que faré
és distribuir els electrons del Si en les capes electròniques. Com aquest té 14
electrons, tindrà 2 electrons en la primera capa, 8 en la segona i 4 en la
tercera, aleshores, observem que l’element amb propietats semblants al Si és el
carboni, ja que els dos tenen quatre electrons en l’última capa.
3. L'heli (He), el neó (Ne) i l'argó (Ar) són tres
exemples de gasos nobles. Si saps que Z(He)=2, Z(Ne)=10, Z(Ar)=18, explica a
partir d'aquestes dades per què els gasos nobles apareixen sols en la natura i
no es combinen amb cap altre element.
El primer que
faré serà distribuir els electrons en les capes, per tant, si l’Heli té 2
electrons en la primera capa (quedant aquesta plena), el Neó té 2 electrons en
la primera capa i 8 en la segona (que també queda completa) i l’Argó té 2
electrons en la primera capa, 8 en la segona i 8 en la tercera (quedant aquesta
també completada). Al tindre tots l’última capa completa, fa que no es combinen
amb altres per mitjà de reaccions químiques, el que els dóna molta estabilitat
i que apareguen en la natura sols sense combinar-se amb altres. Tenen poca
tendència a guanyar o perdre electrons.
4. Els elements metàl·lics apareixen en la natura
formant xarxes cristal·lines metàl·liques, de manera que els seus electrons de
l'última capa circulen lliurement per les xarxes i els cations estan molt
ordenats en l'espai formant empaquetaments molt compactes, com per exemple es
pot veure en la imatge següent:
A partir de la informació donada raona si els metalls
són o no bons conductors de l'electricitat i si els metalls seran molt o poc
densos.
Els elements
metàl·lics són bons conductors de l’electricitat perquè els seus electrons de
l’última capa circulen lliurement per les xarxes, donant lloc al corrent
elèctric. Els metalls també seran molt densos perquè els cations es troben molt
ordenats en l’espai i formen empaquetaments molt compactes. Els àtoms estan
molt junts i es mantenen així gràcies als electrons mòbils (els de l’última capa).
5. Es vol saber si les següents substàncies són
conductores: grafit, aigua destil·lada, sal comuna, aigua amb sal i alumini.
Dissenya un experiment per analitzar si aquestes substàncies són conductores i
explica raonadament si cada substància és conductora i perquè ho és o no ho és.
Podem
comprovar si una substància és o no conductora de l’electricitat construint un
circuit elèctric, per a fer el circuit necessitarem una pila de petaca, un
cable elèctric, un portalàmpades i una bombeta xicoteta. Muntarem el circuit
unint cada extrem del cable a una pestanya de la pila, després unirem un dels
extrems del cable, que està connectat a la pila, a la bombeta. Un altre cable
l’unirem també amb la bombeta. Amb el cable unit a la bombeta i el que queda
lliure unit a la pila, farem contacte amb les substàncies per a saber si són
conductores o no. Si la bombeta s’encén, la substància sí que és conductora, i
si no s’encén, no ho és.
Comprovació:
El grafit és
conductor perquè, en la seua estructura hi ha electrons lliures, que en moure's
produeixen una transferència d’electricitat. Açò ho podem comprovar si unim els
dos cables amb la mina d’un llapis que tinga punta pels dos costats.
L’aigua
destil·lada no és conductora, perquè el que fa que l’aigua siga conductora són
les partícules dissoltes en ella, és a dir, les sals minerals que conté.
Aquesta no és conductora d’electricitat perquè no conté electrons lliures, i
per tant no hi ha conductivitat. Açò ho podem comprovar si fiquem els dos
cables dins l’aigua, i si la bombeta s’encén, és que no és aigua destil·lada
perquè conté sals dissoltes.
La sal comuna
no és conductora en estat sòlid perquè els cations no es poden moure, per tant, no
conduirà l’electricitat. Açò ho podem comprovar si fiquem els cables en un
recipient amb sal.
L’aigua amb
sal dissolta sí que és conductora perquè en ella hi ha anions i cations, que
són els que fan que hi haja conductivitat. Açò ho podem comprovar si fiquem els
dos cables dins d’un recipient que continga aigua amb sal.
L’alumini sí
que és conductor perquè és un metall, i en aquests els electrons de l’última
capa es mouen lliurement, el que fa que siga bon conductor. Açò ho podem
comprovar si unim els dos cables amb una cullera d’alumini.