1. Per què els
gasos nobles no formen ions?
Perquè l’última
capa electrònica està completa, és a dir, hi ha 8 electrons.
2. Quin és l'ió més
probable que formarà un àtom de Na? I un àtom de Mg? I un àtom de
O?
Raona les respostes. Quants electrons tenen en l'última capa els tres ions formats? Dades: Z(O)=8,
Z(Na)=11, Z(Mg)=12.
En distribuir els electrons de Z (Na)=11 en les capes
electròniques, veiem que en la primera capa hi haurà 2 electrons, en la segona
8 i en la tercera 1 electró. Pel que perdrà l’electró de la tercera capa,
quedant la segona completa i formarà el catió Na+.
En distribuir els electrons de Z (Mg)=12 en les capes
electròniques, veiem que en la primera capa hi haurà 2 electrons, en la segona
8 i en la tercera 2 electrons. Pel que perdrà els dos electrons de la tercera
capa i formarà el catió Mg2+.
En distribuir els electrons de Z (O)=8 en les capes
electròniques, veiem que en la primera capa hi haurà 2 electrons i en la segona
6 electrons. Pel que guanyarà dos electrons en la segona capa i formarà l’anió
O2-.
Els tres tindran 8 electrons en l’última capa
electrònica.
3. Indica el nombre de protons, neutrons i electrons que tenen els ions següents:
El primer, té 4
protons perquè Z=4, 5 neutrons perquè A-Z=5 (9-4=5) i 2 electrons perquè Z-n=2
(4-2=2).
El segon, té 8
protons perquè Z=8, 10 neutrons perquè A-Z=10 (18-8=10) i 10 electrons perquè
Z-n=10 (8-(-2)=10).
El tercer, té 15
protons perquè Z=15, 16 neutrons perquè A-Z=16 (31-15=16) i 18 electrons perquè
Z-n=18 (15-(-3)=18).
El quart, té 13
protons perquè Z=13, 14 neutrons perquè A-Z=14 (27-13=14) i 10 electrons perquè
Z-n=10 (13-3=10).
a) Un ió calci (Ca) que té 20 protons, 20 neutrons i 18 electrons.
Z=20, A=20+20=40, n=20-18=+2
b) Un ió de clor (Cl) amb 17 protons, 18 neutrons i 18 electrons.
Z=17, A=17+18=35, n=17-18=-1
c) Un ió de magnesi (Mg) amb 12 protons, 13 neutrons i 10 electrons.
Z=12, A=12+13=25, n=12-10=+2
d) Un ió de rubidi (Rb) que té 37 protons, 48 neutrons i 36 electrons.
Z=37, A=37+48=85, n=37-36=+1
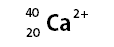


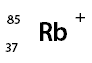
No hay comentarios:
Publicar un comentario